|
BỆNH VIỆN ĐA KHOA THẢO NGUYÊN
KHOA DƯỢC – DƯỢC LÂM SÀNG
THÔNG TIN THUỐC
|

|
|
Chuyên đề An toàn dùng thuốc
|
BẢN TIN SỐ 1
Tháng 10 – 2018
Tài liệu lưu hành nội bộ
|
|
Trong số này:
1. Danh mục thuốc nhìn giống nhau, đọc giống nhau (LASA-Look Alike Sound Alike) sử dụng tại bệnh viện.
2. Tổng kết ADR 9 tháng đầu năm 2018.
|
3. Thông tin về quản lý thuốc:
Đình chỉ lưu hành và thu hồi thuốc không đạt tiêu chuẩn chất lượng
|
DANH MỤC THUỐC NHÌN GIỐNG NHAU ĐỌC GIỐNG NHAU – LASA
|

|
Những thuốc nhìn giống nhau, đọc giống nhau còn gọi là LASA thường dễ bị nhầm lẫn khi sử dụng.
Việc quản lý thuốc LASA cần đảm bảo:
-
Ghi y lệnh rõ ràng tên thuốc, hàm lượng, liều dùng, đường dùng
-
Sắp xếp các thuốc LASA ở vị trí cách xa nhau, tránh nhầm lẫn
-
Kiểm tra chéo ít nhất bởi 2 nhân viên y tế khi đưa thuốc từ kho, quầy đến khoa lâm sàng, khi cấp phát cho bệnh nhân hoặc thực hiện thuốc trên bệnh nhân.
|
|
TT
|
HÌNH ẢNH CỦA THUỐC
|
|
1
|
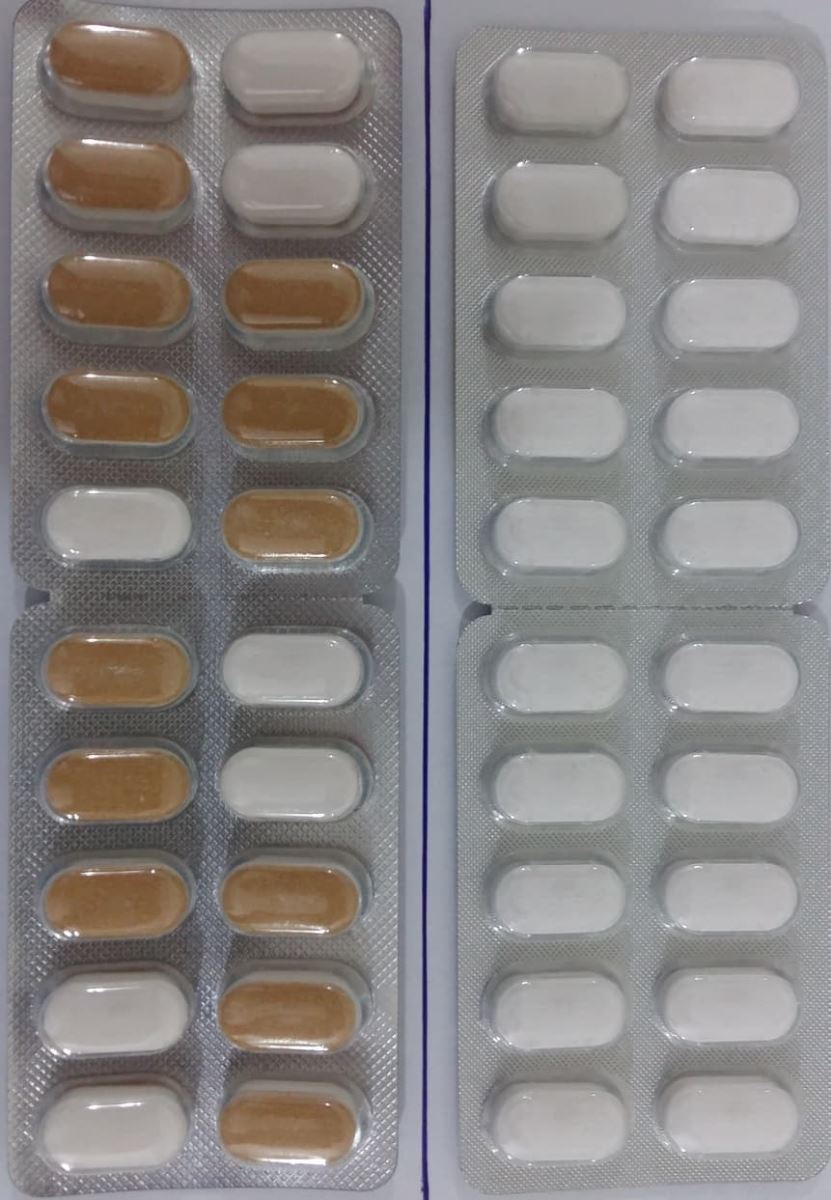
Peglim M-2 PanforSR- 500
|
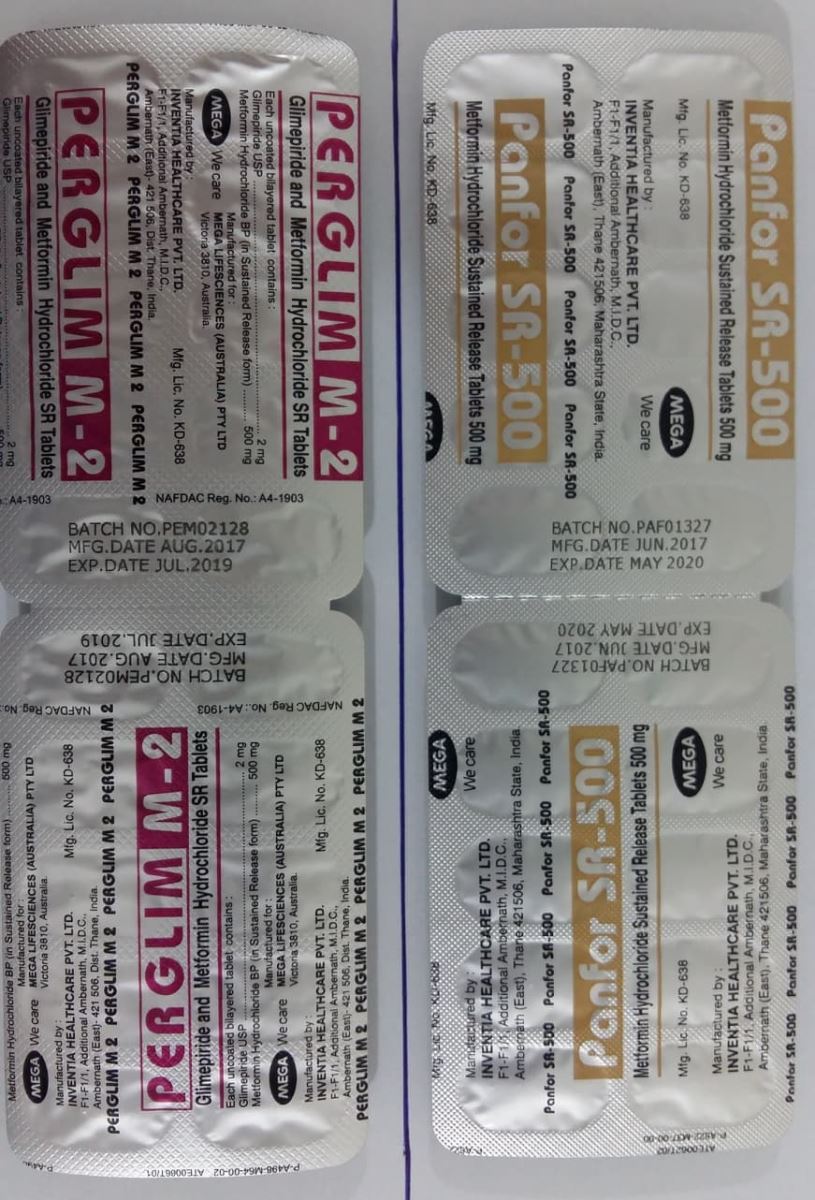
Peglim M-2 PanforSR- 500
|
|
2
|

Frentine Thanh nhiệt tiêu độc Livergood
|
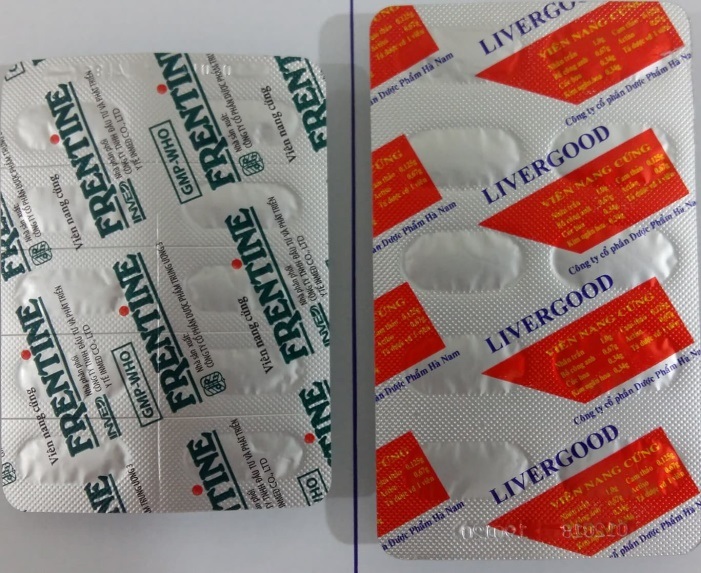
Frentine Thanh nhiệt tiêu độc Livergood
|
|
3
|
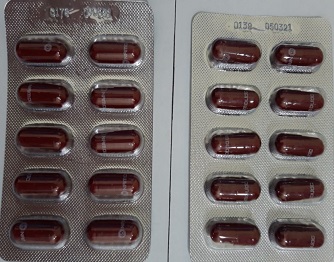
Bổ huyết ích não Thấp khớp Nam Dược
|
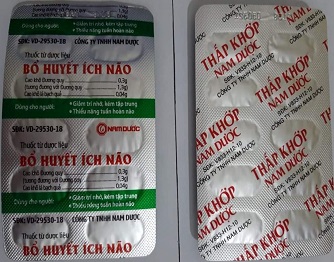
Bổ huyết ích não Thấp khớp Nam Dược
|
|
4
|
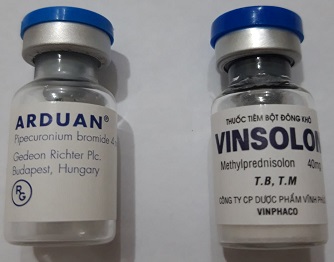
Arduan Vinsolon
|
Arduan
Vinsolon
|
|
5
|

0,9% Sodium Chloride
|

10% Dextrose
|
|
6
|
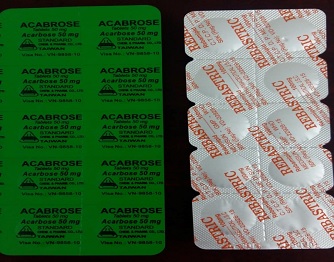
Acabrose 50 mg Rebastric 100mg
|
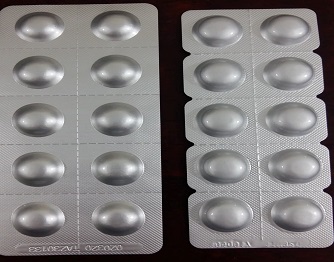
Acabrose 50 mg Rebastric 100mg
|
|
7
|
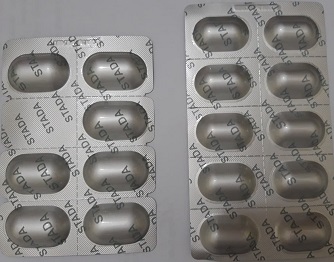
Clarithromycin Stada Tenofovir Stada
|

Clarithromycin Stada Tenofovir Stada
|
|
8
|
Trimpol MR Pelearto 20
|
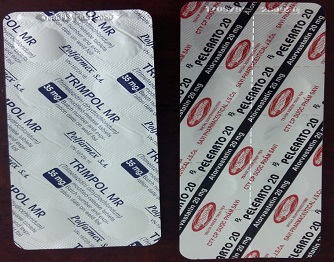
Trimpol MR Pelearto 20
|
|
|
Thuốc đọc giống nhau (Sử dụng kiểu chữ TALLman để phân biệt)
|
|
1
|
.jpg)
BASEthyrox 100 BERLthyrox100
|
.jpg)
BASEthyrox 100 BERLthyrox100
|
|
2
|
.jpg)
TORLaxiME TOXaxiNE
|
|
|
3
|
.jpg)
Nucleo C.M.P Forte 5mg + 3mg viên nang
|
.jpg)
Nucleo C.M.P Forte 10mg + 6mg ống tiêm
|
|
4
|
.jpg)
Nivalin 5mg/ml thuốc tiêm
|
.jpg)
Nivalin 5mg/ viên nén
|
|
_________________________________________________________________________________________________
|
TỔNG KẾT CÔNG TÁC BÁO CÁO ADR 9 THÁNG NĂM 2018

Tổng số báo cáo ADR trong 9 tháng đầu năm 2018 tại Bệnh viện từ các khoa phòng là 27 báo cáo. So với số lượng báo cáo ADR 9 tháng đầu năm 2017 (58 báo cáo), số lượng báo cáo ADR giảm rõ rệt.
Về chất lượng báo cáo ADR: Các báo cáo ADR phần lớn đầy đủ thông tin
1. Phân bố số báo cáo ADR theo Khoa:
|
STT
|
Khoa
|
Số lượng
|
Tỷ lệ
|
|
1
|
Ngoại
|
18
|
66,7
|
|
2
|
Nội
|
6
|
22,2
|
|
3
|
HSCC
|
1
|
3,7
|
|
4
|
X-quang
|
1
|
3,7
|
|
5
|
Sản
|
1
|
3,7
|
|
Tổng cộng:
|
27
|
100
|
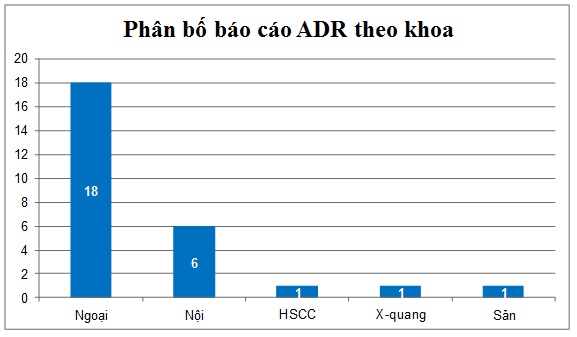
Nhận xét: Khoa Ngoại có số lượng báo cáo ADR nhiều nhất (18 ca) chiếm tỷ lệ 66,7%, tiếp đó là khoa Nội với số lượng báo cáo là 6 chiếm tỷ lệ 22,2 %. Các khoa HSCC, Sản, X-quang có 01 báo cáo, tỷ lệ 3,7%.
2. Phân bố số báo cáo ADR theo nhóm thuốc
|
STT
|
Nhóm thuốc
|
Số báo cáo ADR
|
Tỷ lệ
|
|
1
|
Kháng sinh
|
22
|
81,5
|
|
2
|
Cản quang
|
4
|
14,8
|
|
3
|
Thuốc khác
|
1
|
3,7
|
|
Tổng số
|
27
|
100
|
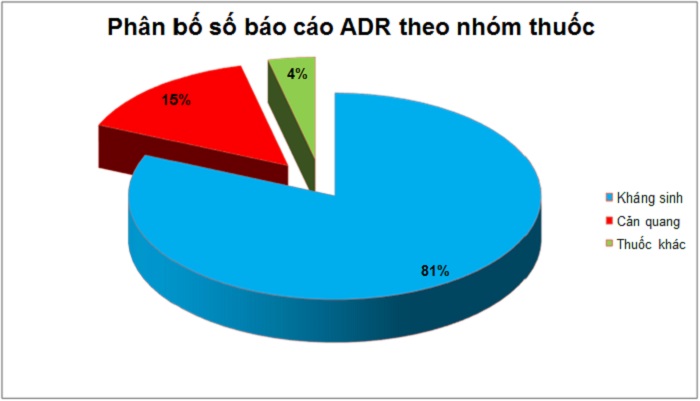
Kháng sinh là nhóm thuốc có tỷ lệ báo cáo ADR nhiều nhất với 22 báo cáo chiếm tỷ lệ 81,5%. Thuốc cản quang có 04 báo cáo chiếm tỷ lệ 14,8%. Thuốc khác có 1 báo cáo chiếm 3,7% là thuốc Olepa inj (Piracetam) 5g/20ml, thuốc được dùng đồng thời với kháng sinh nên không loại trừ.
3. Những thuốc được báo cáo nhiều nhất
Những thuốc nghi ngờ gây phản ứng có hại xuất hiện nhiều nhất trong các báo cáo mà khoa Dược ghi nhận được là:
|
STT
|
Thuốc
|
Số báo cáo ADR
|
Tỷ lệ
|
|
1
|
Ciprobay inj
|
2
|
6,7
|
|
2
|
Seosaft
|
3
|
10
|
|
3
|
Ceftriaxone
|
2
|
6,7
|
|
4
|
Combikit
|
1
|
3,3
|
|
5
|
Ama-power
|
2
|
6,7
|
|
6
|
Omnipaque
|
4
|
13,3
|
|
7
|
Cefe inj ‘Swiss”
|
1
|
3,3
|
|
8
|
Pamecillin
|
3
|
10
|
|
9
|
Torlaxime
|
4
|
13,3
|
|
10
|
Tinidazol
|
1
|
3,3
|
|
11
|
CKD Ceftizoxim
|
1
|
3,3
|
|
12
|
Cloxaxim
|
1
|
3,3
|
|
13
|
Ciprofloxacin
|
1
|
3,3
|
|
14
|
Cetrazole
|
2
|
6,7
|
|
15
|
Olepa inj
|
1
|
3,3
|
|
16
|
Goldoflo
|
1
|
3,3
|
|
Tổng số
|
30
|
100
|
Trong các thuốc kháng sinh, thuốc Torlaxime có tỷ lệ báo cáo ADR nhiều nhất (13,3%), tiếp đó là các kháng sinh Pamecillin và Seosaft có tỷ lệ 10% và kháng sinh Ciprobay, Ama-power, Cetrazole có tỷ lệ báo cáo là 6,7%.
Thuốc cản quang Omnipaque có 4 trường hợp xuất hiện phản ứng ADR chiếm tỷ lệ 13,3%.
4. Phân bố báo cáo theo đường dùng
|
STT
|
Đường dùng
|
Số báo cáo ADR
|
Tỷ lệ
|
|
1
|
Tiêm, truyền tĩnh mạch
|
17
|
63
|
|
2
|
Uống
|
0
|
0
|
|
3
|
Test
|
10
|
37
|
|
Tổng số
|
27
|
100
|
Đường tiêm truyền tĩnh mạch chiếm tỷ lệ cao trong số các báo cáo ADR ghi nhận được (63%), test phản ứng có 10 báo cáo chiếm tỷ lệ 37%, không có trường hợp báo cáo phản ứng có hại nào khi sử dụng thuốc theo đường uống.
5. Chú ý khi sử dụng Cefotaxim (Torlaxime) (Dược thư Quốc gia 2018)
Dùng cefotaxim theo đường tiêm bắp sâu hay tiêm hoặc truyền tĩnh mạch chậm (tiêm tĩnh mạch chậm từ 3 đến 5 phút; tiêm nhanh dưới 3 phút có thể gây nguy hiểm đến tính mạng do liên quan đến chứng loạn nhịp tim; truyền tĩnh mạch trong vòng từ 20 đến 60 phút). Do liều lớn tiêm bắp có thể gây đau nên các thầy thuốc khuyên nên dùng đường tĩnh mạch đối với các liều lớn.
Pha thuốc tiêm tĩnh mạch không liên tục: Thêm 10 ml nước để pha thuốc tiêm vào lọ thuốc có chứa 500 mg, hoặc 1 g, hoặc 2 g cefotaxim để được dung dịch có nồng độ thuốc khoảng 50, hoặc 95, hoặc 180 mg/1 ml.
Tiêm truyền tĩnh mạch liên tục và không liên tục: Thêm 50 hoặc 100 ml dung dịch tiêm natri clorid 0,9% hoặc dung dịch tiêm dextrose 5% vào chai truyền có chứa 1 g, hoặc 2 g cefotaxim; hoặc dùng những dung dịch đã hoàn nguyên của cefotaxim được hòa loãng với từ 50 ml đến 1000 ml dung dịch tiêm truyền tĩnh mạch thích hợp.
Tiêm bắp: Thêm 2, 3 hoặc 5 ml nước vô khuẩn để tiêm vào lọ chứa 500 mg, 1 g hoặc 2 g thuốc để đạt được dung dịch có chứa cefotaxim khoảng 230, 300 hoặc 330 mg/ml. Nên tiêm bắp sâu vào những cơ bắp to. Nhà sản xuất khuyến cáo nếu tiêm liều 2 g nên tiêm vào 2 vị trí khác nhau.
NHẮC LẠI HƯỚNG DẪN XỬ TRÍ CẤP CỨU PHẢN VỆ
(Ban hành kèm theo Thông tư 51/2017/TT-BYT ngày 29 tháng 12 năm 2017)
I. Nguyên tắc chung
1. Tất cả trường hợp phản vệ phải được phát hiện sớm, xử trí khẩn cấp, kịp thời ngay tại chỗ và theo dõi liên tục ít nhất trong vòng 24 giờ.
2. Bác sĩ, điều dưỡng, hộ sinh viên, kỹ thuật viên, nhân viên y tế khác phải xử trí ban đầu cấp cứu phản vệ.
3. Adrenalin là thuốc thiết yếu, quan trọng hàng đầu cứu sống người bệnh bị phản vệ, phải được tiêm bắp ngay khi chẩn đoán phản vệ từ độ II trở lên.
4. Ngoài hướng dẫn này, đối với một số trường hợp đặc biệt còn phải xử trí theo hướng dẫn tại Phụ lục IV ban hành kèm theo Thông tư này.
II. Xử trí phản vệ nhẹ (độ I): dị ứng nhưng có thể chuyển thành nặng hoặc nguy kịch
1. Sử dụng thuốc methylprednisolon hoặc diphenhydramin uống hoặc tiêm tùy tình trạng người bệnh.
2. Tiếp tục theo dõi ít nhất 24 giờ để xử trí kịp thời.
III. Phác đồ xử trí cấp cứu phản vệ mức nặng và nguy kịch (độ II, III)
Phản vệ độ II có thể nhanh chóng chuyển sang độ III, độ IV. Vì vậy, phải khẩn trương, xử trí đồng thời theo diễn biến bệnh:
1. Ngừng ngay tiếp xúc với thuốc hoặc dị nguyên (nếu có).
2. Tiêm hoặc truyền adrenalin (theo mục IV dưới đây).
3. Cho người bệnh nằm tại chỗ, đầu thấp, nghiêng trái nếu có nôn.
4. Thở ô xy: người lớn 6-101/phút, trẻ em 2-41/phút qua mặt nạ hở.
5. Đánh giá tình trạng hô hấp, tuần hoàn, ý thức và các biểu hiện ở da, niêm mạc của người bệnh.
a) Ép tim ngoài lồng ngực và bóp bóng (nếu ngừng hô hấp, tuần hoàn).
b) Đặt nội khí quản hoặc mở khí quản cấp cứu (nếu khó thở thanh quản).
6. Thiết lập đường truyền adrenalin tĩnh mạch với dây truyền thông thường nhưng kim tiêm to (cỡ 14 hoặc 16G) hoặc đặt catheter tĩnh mạch và một đường truyền tĩnh mạch thứ hai để truyền dịch nhanh (theo mục IV dưới đây).
7. Hội ý với các đồng nghiệp, tập trung xử lý, báo cáo cấp trên, hội chẩn với bác sĩ chuyên khoa cấp cứu, hồi sức và/hoặc chuyên khoa dị ứng (nếu có).
IV. Phác đồ sử dụng adrenalin và truyền dịch
Mục tiêu: nâng và duy trì ổn định HA tối đa của người lớn lên ≥ 90mmHg, trẻ em ≥ 70mmHg và không còn các dấu hiệu về hô hấp như thở rít, khó thở; dấu hiệu về tiêu hóa như nôn mửa, ỉa chảy.
1. Thuốc adrenalin 1mg = 1ml = 1 ống, tiêm bắp:
a) Trẻ sơ sinh hoặc trẻ < 10kg: 0,2ml (tương đương 1/5 ống).
b) Trẻ khoảng 10 kg: 0,25ml (tương đương 1/4 ống).
c) Trẻ khoảng 20 kg: 0,3ml (tương đương 1/3 ống).
d) Trẻ > 30kg: 0,5ml (tương đương 1/2 ống).
e) Người lớn: 0,5-1 ml (tương đương 1/2-1 ống).
2. Theo dõi huyết áp 3-5 phút/lần.
3. Tiêm nhắc lại adrenalin liều như khoản 1 mục IV 3-5 phút/lần cho đến khi huyết áp và mạch ổn định.
4. Nếu mạch không bắt được và huyết áp không đo được, các dấu hiệu hô hấp và tiêu hóa nặng lên sau 2-3 lần tiêm bắp như khoản 1 mục IV hoặc có nguy cơ ngừng tuần hoàn phải:
a) Nếu chưa có đường truyền tĩnh mạch: Tiêm tĩnh mạch chậm dung dịch adrenalin 1/10.000 (1 ống adrenalin 1mg pha với 9ml nước cất = pha loãng 1/10). Liều adrenalin tiêm tĩnh mạch chậm trong cấp cứu phản vệ chỉ bằng 1/10 liều adrenalin tiêm tĩnh mạch trong cấp cứu ngừng tuần hoàn. Liều dùng:
- Người lớn: 0,5-1 ml (dung dịch pha loãng 1/10.000=50-100µg) tiêm trong 1-3 phút, sau 3 phút có thể tiêm tiếp lần 2 hoặc lần 3 nếu mạch và huyết áp chưa lên. Chuyển ngay sang truyền tĩnh mạch liên tục khi đã thiết lập được đường truyền.
- Trẻ em: Không áp dụng tiêm tĩnh mạch chậm.
b) Nếu đã có đường truyền tĩnh mạch, truyền tĩnh mạch liên tục adrenalin (pha adrenalin với dung dịch natriclorid 0,9%) cho người bệnh kém đáp ứng với adrenalin tiêm bắp và đã được truyền đủ dịch. Bắt đầu bằng liều 0,1 µg/kg/phút, cứ 3-5 phút điều chỉnh liều adrenalin tùy theo đáp ứng của người bệnh.
c) Đồng thời với việc dùng adrenalin truyền tĩnh mạch liên tục, truyền nhanh dung dịch natriclorid 0,9% 1.000ml-2.000ml ở người lớn, 10-20ml/kg trong 10-20 phút ở trẻ em có thể nhắc lại nếu cần thiết.
5. Khi đã có đường truyền tĩnh mạch adrenalin với liều duy trì huyết áp ổn định thì có thể theo dõi mạch và huyết áp 1 giờ/lần đến 24 giờ.
Khoa Dược – Tổ Dược lâm sàng
THÔNG TIN VỀ QUẢN LÝ THUỐC
Các công văn số 1739; 1740;1746/SYT-NVD ngày 16 tháng 10 năm 2018 của Sở y tế Sơn La về việc đình chỉ lưu hành và thu hồi thuốc không đạt tiêu chuẩn chất lượng. Cụ thể:
|
|
1. Bột pha hỗn dịch uống Batimin 125 (Cefdinir 125mg), SĐK: VD-25824-16, số lô: 0417; NSX: 08/11/2017; HSD: 08/11/2020 do Công ty cổ phần dược phẩm và sinh học y tế sản xuất. Thuốc không đạt tiêu chuẩn về chỉ tiêu tính chất và định lượng.
|
|
|
2. Thuốc viên nén PASAPIL (enalapril); SĐK: VN-15829-12, số lô:14; NSX: 04/2017; HD: 14/01/2020 do Công ty S.C Arena Group S.A (Romania) sản xuất, Công ty TNHH MTV dược Sài Gòn (SAPHARCO) nhập khẩu, Công ty TNHH Dược phẩm Minh Trí ủy thác nhập khẩu. Thuốc không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng.
|
|

|
3. Thuốc Thần tiên nhãn hiệu sư tử lớn và Thuốc 092414343. Theo kết quả kiểm nghiệm của Viện Kiểm nghiệm thuốc thành phố Hồ Chí Minh phát hiện tân dược trong thuốc đông dược.
|
Bệnh viện đã tiến hành rà soát danh mục thuốc sử dụng tại đơn vị và Nhà thuốc. Hiện tại đơn vị không có các loại thuốc trên.

Mọi ý kiến đóng góp và yêu cầu thông tin thuốc gửi về:
TỔ DƯỢC LÂM SÀNG
Khoa Dược – Bệnh viện đa khoa Thảo Nguyên huyện Mộc Châu
Email: khoaduocbvdkthaonguyen@gmail.com
Chỉ đạo nội dung:
BS.Trần Hữu Hùng
Ban Biên Tập: Tổ Dược lâm sàng
DS. Trần Thị Hồng
DS. Nguyễn Phan Thị Bảo Dương
DS. Ma Thanh Hằng